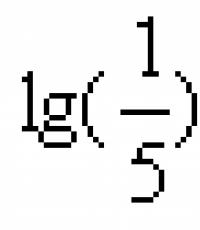O fígado também desempenha uma função excretora, liberando sais biliares, bilirrubina, colesterol, ácidos graxos, lecitina, cálcio, cloro, sódio e bicarbonatos do corpo. Reação sanguínea. Sistemas tampão. Equilíbrio ácido-base (ABC) Distúrbios ácido-base
1. Agapov Yu.Ya. Equilíbrio ácido-base. – M., 1968. – 184 p.
2. Voinov V.A. Atlas de fisiopatologia. – M., 2004. – 218 p.
3. Gusev G.P. O papel do rim na regulação do equilíbrio ácido-base // Fisiologia do rim: Um guia de fisiologia. – L., 1972. – S. 142–168.
4. Zhalko-Titarenko V.F. Metabolismo hidroeletrolítico e estado ácido-base em condições normais e patológicas. – Kyiv, 1989.
5. Kostyuchenko S.S. Equilíbrio ácido-base em terapia intensiva. – Minsk, 2009. – 268 p.
6. Losev N.I., Voinov V.A. Homeostase físico-química do corpo // Homeostase / Ed. PD Horizonte. – M., 1981. – S. 186–240.
7.Malyshev V.D. Estado ácido-base e equilíbrio hidroeletrolítico em terapia intensiva: livro didático. – M.: OJSC “Editora “Medicina”, 2005. – 228 p.
8. Ruth G. Status ácido-base e equilíbrio eletrolítico. – M., 1978. 118 p.
9. Tavs G. Gases sanguíneos e equilíbrio ácido-base // Fisiologia Humana. T.3/Ed. R. Schmidt e G. Tavs. – M., 1986. – S. 241–268.
10. Heitz U., Horn M. Água-eletrólito e equilíbrio ácido-base: um breve guia. – M.: BINOM. Laboratório do Conhecimento, 2009. – 359 p.
11. Hruska K. Fisiopatologia do metabolismo ácido-base // Rins e homeostase em saúde e patologia. – M., 1987. – S. 170–216.
O estado ácido-base (ABS) do corpo é um dos parâmetros mais importantes e mais estritamente estabilizados da homeostase. A proporção de íons hidrogênio e hidroxila no ambiente interno do corpo determina a atividade de enzimas, hormônios, a intensidade e direção das reações redox, os processos metabólicos de proteínas, carboidratos e gorduras, as funções de vários órgãos e sistemas, a constância de metabolismo de água e eletrólitos, permeabilidade e excitabilidade de membranas biológicas e etc. A atividade da reação do meio ambiente afeta a capacidade da hemoglobina de se ligar ao oxigênio e liberá-lo nos tecidos.
A reação ativa do meio ambiente é geralmente avaliada pelo conteúdo de íons hidrogênio em líquidos.
O valor do pH é um dos parâmetros sanguíneos mais “estritos” e normalmente flutua dentro de uma faixa muito estreita em humanos - o pH do sangue arterial é 7,35-7,45; venoso - 7,32-7,42. Mudanças mais significativas no pH do sangue estão associadas a distúrbios metabólicos patológicos. Em outros fluidos e células corporais, o pH pode diferir do pH do sangue.
Mudanças no pH do sangue além dos limites especificados levam a mudanças significativas nos processos redox, mudanças na atividade enzimática, permeabilidade das membranas biológicas e causam distúrbios na função dos sistemas cardiovascular, respiratório e outros; uma mudança de 0,3 pode causar estados de coma, e uma mudança de 0,4 é frequentemente incompatível com a vida.
O estado ácido-base é mantido por poderosos mecanismos homeostáticos. Baseiam-se nas peculiaridades das propriedades físico-químicas dos sistemas tampão sanguíneos e nos processos fisiológicos dos quais participam os sistemas respiratórios externos, rins, fígado, trato gastrointestinal, etc.
Os sistemas tampão químicos formam a primeira linha de defesa contra alterações no pH dos fluidos corporais e atuam para preveni-las rapidamente.
Um sistema tampão é uma mistura que tem a capacidade de evitar alterações no pH do meio quando ácidos ou bases são adicionados a ele. Os sistemas tampão não removem o H+ do corpo, mas o “ligam” ao seu componente alcalino até a restauração final do CBS. Misturas que consistem em um ácido fraco e seu sal contendo uma base forte, ou uma base fraca e um sal de um ácido forte têm propriedades tamponantes.
Os sistemas tampão sanguíneos mais espaçosos são bicarbonato, fosfato, proteína e hemoglobina. Os três primeiros sistemas desempenham um papel particularmente importante no plasma sanguíneo, e o tampão de hemoglobina, o mais poderoso, atua nos eritrócitos.
O tampão bicarbonato é o sistema tampão extracelular mais importante e consiste em ácido carbônico fraco H2CO3 e seu sal de ânion, uma base forte. O ácido carbônico é formado como resultado da interação do dióxido de carbono e da água: CO2 + H2O ↔ H2CO3. O ácido carbônico, por sua vez, dissocia-se em hidrogênio e bicarbonato: H2CO3 ↔ H+ + HCO3-.
Em condições normais (com um pH sanguíneo de cerca de 7,4), há 20 vezes mais bicarbonato no plasma do que dióxido de carbono.
A capacidade do sistema bicarbonato é responsável por 53% da capacidade tampão total do sangue. Ao mesmo tempo, o bicarbonato plasmático representa 35% e o bicarbonato eritrocitário 18% da capacidade tampão.
Quando um excesso de produtos que reagem com ácido é formado no plasma, os íons hidrogênio se combinam com os ânions bicarbonato (). O excesso de dióxido de carbono formado no plasma entra nos glóbulos vermelhos e ali, com a ajuda da anidrase carbônica, é decomposto em dióxido de carbono e água. O dióxido de carbono é liberado no plasma, estimula o centro respiratório e o excesso de CO2 é removido do corpo através dos pulmões. Esta rápida conversão de qualquer ácido pelo bicarbonato em ácido carbônico, que é facilmente removido pelos pulmões, torna o tampão bicarbonato o sistema tampão mais lábil.
Um tampão de bicarbonato também pode neutralizar o excesso de bases. Nesse caso, os íons OHˉ serão ligados ao dióxido de carbono e em vez da base mais forte OHˉ, forma-se uma base mais fraca, cujo excesso é excretado pelos rins na forma de sais de bicarbonato.
Desde que a quantidade de ácido carbônico e bicarbonato de sódio mude proporcionalmente e a proporção entre eles permaneça 1:20, o pH do sangue permanece dentro dos limites normais.
O tampão fosfato é representado por sais de fosfatos mono e dissubstituídos. O sistema tampão de fosfato fornece 5% da capacidade tampão do sangue e é o principal sistema tampão das células.
Um sal monossubstituído possui propriedades ácidas, pois ao se dissociar produz um íon, que é então capaz de liberar um íon hidrogênio: NaH2PO4 ⇒ Na+ + ; ⇒Н+ + . O fosfato dissubstituído tem propriedades de base, pois se dissocia para formar um íon que pode se ligar a um íon hidrogênio: + H+ ⇒.
Em pH normal no plasma, a proporção de sais de fosfato NaH2PO4: Na2HPO4 = 1:4. Este tampão é importante na regulação renal da CBS, bem como na regulação da resposta de determinados tecidos. No sangue, seu efeito se reduz principalmente à manutenção da constância e reprodução do tampão bicarbonato.
O sistema tampão de proteínas é um tampão bastante poderoso que é capaz de exibir suas propriedades devido à natureza anfotérica das proteínas. O sistema tampão de proteínas fornece 7% da capacidade tampão do sangue. As proteínas do plasma sanguíneo contêm uma quantidade suficiente de radicais ácidos e básicos, portanto este sistema tampão atua dependendo do ambiente em que as proteínas se dissociam.
O buffer de hemoglobina é o sistema tampão mais espaçoso. É responsável por até 75% da capacidade tampão total do sangue. As propriedades de um sistema tampão são dadas à hemoglobina principalmente por sua capacidade de existir constantemente na forma de duas formas - hemoglobina HHb reduzida (reduzida) e HbO2 oxidada (oxihemoglobina).
O tampão de hemoglobina, ao contrário do tampão de bicarbonato, é capaz de neutralizar ácidos não voláteis e voláteis. A hemoglobina oxidada se comporta como um ácido, aumentando a concentração de íons hidrogênio, e a reduzida (desoxigenada) se comporta como uma base, neutralizando o H+.
A hemoglobina é um exemplo clássico de tampão proteico e sua eficácia é bastante elevada. A hemoglobina é seis vezes mais eficaz como tampão do que as proteínas plasmáticas.
A transição da forma oxidada da hemoglobina para a forma reduzida evita uma mudança no pH para o lado ácido durante o contato do sangue com os tecidos, e a formação de oxiemoglobina nos capilares pulmonares evita uma mudança no pH para o lado alcalino devido à liberação de CO2 e íons cloro dos eritrócitos e a formação de bicarbonato neles.
O sistema amônia/íon amônio (NH3/NH4+) - atua principalmente na urina.
Além dos sistemas tampão, os sistemas fisiológicos participam ativamente na manutenção do pH constante, entre os quais os principais são os pulmões, rins, fígado e trato gastrointestinal.
O sistema respiratório desempenha um papel significativo na manutenção do equilíbrio ácido-base do corpo, mas leva de 1 a 3 minutos para nivelar a mudança no pH do sangue. O papel dos pulmões se resume a manter as concentrações normais de dióxido de carbono, e o principal indicador do estado funcional dos pulmões é a tensão parcial de dióxido de carbono no sangue. Os mecanismos pulmonares proporcionam compensação temporária, pois deslocam a curva de dissociação da oxiemoglobina para a esquerda e diminuem a capacidade de oxigênio do sangue arterial.
Em um estado estacionário de troca gasosa, os pulmões removem cerca de 850 g de dióxido de carbono por dia. Se a tensão de dióxido de carbono no sangue aumentar acima do normal em 10 mmHg. Art., a ventilação aumenta 4 vezes.
O papel dos rins na regulação da reação ativa do sangue não é menos importante que a atividade do sistema respiratório. O mecanismo de compensação renal é mais lento que o respiratório. A compensação renal completa se desenvolve apenas alguns dias após a alteração do pH.
A excreção de ácidos durante a alimentação mista normal em uma pessoa saudável excede a excreção de bases, de modo que a urina tem uma reação ácida (pH 5,3-6,5) e a concentração de íons hidrogênio nela é aproximadamente 800 vezes maior do que no sangue. Os rins produzem e excretam na urina uma quantidade de íons hidrogênio equivalente à quantidade que entra continuamente no plasma vindo das células do corpo, enquanto substituem os íons hidrogênio secretados pelo epitélio tubular por íons sódio na urina primária. Este mecanismo é realizado através de vários processos químicos.
O primeiro deles é o processo de reabsorção de sódio durante a conversão dos fosfatos dibásicos em monossubstituídos. Quando o tampão fosfato se esgota (pH da urina abaixo de 4,5), o sódio e o bicarbonato são reabsorvidos por meio da amoniagênese.
O segundo processo, que garante a retenção do sódio no organismo e a retirada do excesso de íons hidrogênio, é a conversão dos bicarbonatos em ácido carbônico na luz dos túbulos.
O terceiro processo que contribui para a retenção de sódio no organismo é a síntese de amônia nos túbulos renais distais (amoniogênese) e seu uso para neutralizar e excretar equivalentes ácidos na urina.
A amônia livre resultante penetra facilmente no lúmen dos túbulos, onde, combinando-se com um íon hidrogênio, se transforma em um cátion amônio pouco difusível, que não é capaz de retornar à célula da parede tubular.
Em geral, a concentração de íons hidrogênio na urina pode exceder a concentração de íons hidrogênio no sangue em várias centenas de vezes.
Isso indica a enorme capacidade dos rins de remover íons hidrogênio do corpo.
Os mecanismos renais de regulação do trato respiratório não conseguem ajustar o pH em poucos minutos, como o mecanismo respiratório, mas funcionam por vários dias até que o pH retorne aos níveis normais.
Regulação do CBS com participação do fígado. O fígado oxida substâncias suboxidadas no sangue que flui dos intestinos para os produtos finais; sintetiza uréia a partir de resíduos nitrogenados, em particular de amônia e cloreto de amônio, provenientes do trato gastrointestinal para o sangue da veia porta; O fígado tem função excretora e, portanto, quando quantidades excessivas de produtos metabólicos ácidos ou alcalinos se acumulam no corpo, eles podem ser excretados com a bile no trato gastrointestinal. Com excesso de ácidos no fígado, sua neutralização aumenta e ao mesmo tempo a formação de uréia é inibida. A amônia não utilizada neutraliza os ácidos e aumenta a excreção de sais de amônio na urina. Com o aumento da quantidade de valências alcalinas, a formação urinária aumenta e a amoniaogênese diminui, o que é acompanhado por uma diminuição na excreção de sais de amônio na urina.
A concentração de íons hidrogênio no sangue também depende da atividade do estômago e dos intestinos. As células da mucosa gástrica secretam ácido clorídrico em concentrações muito elevadas. Nesse caso, os íons cloro são liberados do sangue para a cavidade gástrica em combinação com os íons hidrogênio formados no epitélio gástrico com a participação da anidrase carbônica. Em vez de cloretos, o bicarbonato entra no plasma durante a secreção gástrica.
O pâncreas está ativamente envolvido na regulação do pH do sangue, pois gera grandes quantidades de bicarbonato. A formação de bicarbonato é inibida pelo excesso de ácidos e potencializada pela sua deficiência.
A pele pode, sob condições de excesso de ácidos e bases não voláteis, liberar estes últimos através do suor. Isto é de particular importância em casos de insuficiência renal.
Osso. Este é o sistema de reação mais lenta. O mecanismo de sua participação na regulação do pH sanguíneo é a capacidade de trocar íons Ca2+ e Na+ com o plasma sanguíneo em troca de prótons H+. Ocorre a dissolução dos sais de hidroxiapatita de cálcio da matriz óssea, a liberação de íons Ca2+ e a ligação dos íons HPO42- com H+ para formar dihidrogenofosfato, que é excretado na urina. Paralelamente, com a diminuição do pH (acidificação), os íons H+ entram nos osteócitos e os íons potássio saem.
Avaliação do estado ácido-base do corpo
Ao estudar o equilíbrio ácido-base, os exames de sangue são de maior importância. Os indicadores no sangue capilar são próximos aos do sangue arterial. Atualmente, os indicadores CBS são determinados usando o micrométodo de equilíbrio Astrup. Esta técnica permite, além do pH sanguíneo verdadeiro, obter um indicador de tensão de CO2 no plasma (pCO2), bicarbonato sanguíneo verdadeiro (AB), bicarbonato padrão (SB), soma de todas as bases sanguíneas (BB) e um indicador de deficiência ou excesso de base (BE).
Link bibliográfico
Morrison V.V., Chesnokova NP, Bizenkova MN. ESTADO ÁCIDO-BASE. REGULAÇÃO DA HOMEOSTASE ÁCIDO-BASE (AULA 1) // International Journal of Applied and Fundamental Research. – 2015. – Nº 3-2. – P. 270-273;URL: https://applied-research.ru/ru/article/view?id=6529 (data de acesso: 15/06/2019). Chamamos a sua atenção revistas publicadas pela editora "Academia de Ciências Naturais"
2. Sistemas tampão de sangue. O papel dos sistemas tampão na manutenção da homeostase do pH. Estado ácido-base. O conceito de acidose e alcalose.
No corpo, a formação de ácidos predomina sobre a formação de compostos básicos.
Fontes de H+ no corpo:
1. ácido volátil H2CO3, 10-20 mil mmol de CO2 por dia durante a oxidação de proteínas, F, U.
2. ácidos não voláteis por dia. 70 mmol:
Fosfórico ao quebrar fosfatos orgânicos (nucleotídeos, PL, fosfoproteínas)
Sulfúrico, clorídrico durante a oxidação B
3.org.k-you: leite, corpos cetônicos, PVC, etc.
O pH é mantido em nível levemente alcalino devido à participação de células tampão e controle fisiológico (função excretora dos rins e função respiratória dos pulmões)
Equação de Henderson-Hesselbach: pH = pKa + log [acumulador de prótons]/[doador de prótons].
(Sal) (ácido)
Qualquer tampão consiste em um par ácido-base conjugado: doador de prótons + aceitador.
Capacidade tampão: depende das concentrações absolutas dos componentes tampão.
Bicarbonato.
10% de capacidade sanguínea tampão.
Com pH normal do sangue (7,4), a concentração de íons bicarbonato HCO 3 no plasma sanguíneo excede a concentração de CO 2 em aproximadamente 20 vezes. O sistema tampão de bicarbonato funciona como um regulador eficaz na faixa de pH de 7,4.
O mecanismo de ação deste sistema é que quando quantidades relativamente grandes de produtos ácidos são liberadas no sangue, os íons hidrogênio H + interagem com os íons bicarbonato HCO 3 –, o que leva à formação de ácido carbônico H 2 CO 3 de dissociação fraca. Uma diminuição subsequente na concentração de H 2 CO 3 é alcançada como resultado da liberação acelerada de CO 2 através dos pulmões como resultado de sua hiperventilação (lembre-se de que a concentração de H 2 CO 3 no plasma sanguíneo é determinada pelo pressão de CO 2 na mistura de gases alveolares).
Se a quantidade de bases no sangue aumentar, elas interagem com o ácido carbônico fraco para formar íons bicarbonato e água. Neste caso, não ocorrem alterações perceptíveis no valor do pH. Além disso, para manter uma relação normal entre os componentes do sistema tampão, neste caso, são ativados mecanismos fisiológicos de regulação do equilíbrio ácido-base: uma certa quantidade de CO 2 é retida no plasma sanguíneo como resultado da hipoventilação do pulmões.
NaHCO3 + H+ → Na+ + H2CO3
Reabs nos rins ↓anidrase carbônica
↓aumento da ventilação dos pulmões
O fosfato é um par ácido-base conjugado que consiste em um íon H 2 PO 4 – (doador de prótons) e um íon HPO 4 2 – (aceitador de prótons):
 O sistema tampão de fosfato representa apenas 1% da capacidade tampão do sangue. No líquido extracelular, incluindo sangue, a proporção [HPO 4 2– ]: [H 2 PO 4 – ] é de 4:1. O efeito tampão do sistema fosfato é baseado na possibilidade de ligação de íons hidrogênio com íons HPO 4 2– para formar H 2 PO 4 – (H + + + HPO 4 2– -> H 2 PO 4 –), bem como OH – íons com íons H 2 PO 4 – (OH – + + H 2 R O 4 – -> HPO 4 2– + H 2 O). O par tampão (H 2 PO 4 – –HPO 4 2–) é capaz de influenciar mudanças no pH na faixa de 6,1 a 7,7 e pode fornecer uma certa capacidade tampão do fluido intracelular, cujo valor de pH está na faixa de 6,9–7, 4. No sangue, a capacidade máxima do tampão fosfato aparece em torno do valor de pH de 7,2.
O sistema tampão de fosfato representa apenas 1% da capacidade tampão do sangue. No líquido extracelular, incluindo sangue, a proporção [HPO 4 2– ]: [H 2 PO 4 – ] é de 4:1. O efeito tampão do sistema fosfato é baseado na possibilidade de ligação de íons hidrogênio com íons HPO 4 2– para formar H 2 PO 4 – (H + + + HPO 4 2– -> H 2 PO 4 –), bem como OH – íons com íons H 2 PO 4 – (OH – + + H 2 R O 4 – -> HPO 4 2– + H 2 O). O par tampão (H 2 PO 4 – –HPO 4 2–) é capaz de influenciar mudanças no pH na faixa de 6,1 a 7,7 e pode fornecer uma certa capacidade tampão do fluido intracelular, cujo valor de pH está na faixa de 6,9–7, 4. No sangue, a capacidade máxima do tampão fosfato aparece em torno do valor de pH de 7,2.
1 e 2 – saída.
A proteína é menos importante para manter o COR no plasma sanguíneo do que outros sistemas tampão. As proteínas formam um sistema tampão devido à presença de grupos ácido-base na molécula de proteína: proteína –H + (ácido, doador de prótons) e proteína (base conjugada, aceitador de prótons). O sistema tampão de proteína do plasma sanguíneo é eficaz na faixa de pH de 7,2–7,4.
O sistema tampão da hemoglobina é o sistema tampão mais poderoso do sangue. É 9 vezes mais potente que um tampão de bicarbonato; é responsável por 75% da capacidade tampão total do sangue. consiste em hemoglobina não ionizada HHb (ácido orgânico fraco, doador de prótons) e sal de potássio da hemoglobina KHb (base conjugada, aceitador de prótons). O sistema tampão da oxiemoglobina pode ser considerado da mesma maneira. O sistema de hemoglobina e o sistema de oxiemoglobina são sistemas interconversíveis e existem como um todo.
Mecanismo de ação:
Nos tecidos: H2O + CO2 (anidrase carbônica) -> H2CO3 -> H + + HCO3 - (difunde-se no plasma sanguíneo)
KNvO2 ->KNv + 4O2
KHb + 2H+ -> HHb + 2K+ (K-hemoglobina neutraliza íons H+)
Nos pulmões: HHb + 4O2 -> 2H+ + HbO2
2H+ + HBO2 + 2K+ + 2HCO3- ->KHBO2 + 2H2CO3 (anidrase carbônica) ->H2O + 2CO2
O pH e a concentração de CO2 afetam a liberação e ligação de O2 pela nemoglobina - efeito Boro.
Aumentar a concentração de prótons, CO2, promove a liberação de O2, e aumentar a concentração de O2 estimula a liberação de CO2 e prótons.
Estado Ácido-Base (ABS)- a relativa constância da reação do meio interno do corpo, caracterizada quantitativamente pela concentração de H +.
A concentração de H+ é expressa usando o valor do pH. A concentração de H + e, consequentemente, o valor do pH, dependem da proporção de ácidos e bases no corpo.
Ácidos de Bronsted - moléculas ou íons capazes de doar H +.
Fundações Brønsted - compostos capazes de aceitar H +.
O ácido mais comum no corpo é o ácido carbônico, cerca de 20 moles são formados por dia; O corpo também produz outros ácidos inorgânicos (clorídrico, sulfúrico, fosfórico) e orgânicos (amino-, ceto-, hidroxi-, nucleico, gordo) numa quantidade de 80 mmol/dia.
o mais forte deles é a amônia. Os aminoácidos arginina e lisina, aminas biogênicas, por exemplo, catecolaminas, histamina, serotonina, etc. também possuem propriedades básicas.
Significado biológico da regulação do pH, consequências das violações
H + são partículas com carga positiva; elas se unem a grupos de moléculas e ânions com carga negativa, e como resultado alteram sua composição e propriedades. Assim, a quantidade de H + em um líquido determina a estrutura e as propriedades de todos os principais grupos de compostos orgânicos - proteínas, ácidos nucléicos, carboidratos e lipídios (anfifílicos). O efeito mais importante da concentração de H+ está na atividade enzimática. Cada enzima tem seu próprio pH ideal, no qual a enzima tem atividade máxima. Por exemplo, as enzimas da glicólise, do ciclo TCA e do PFS são ativas em um ambiente neutro, e as enzimas lisossomais e as enzimas estomacais são ativas em um ambiente ácido (pH = 2). Como resultado, alterações no pH provocam alterações na atividade de enzimas individuais e levam a distúrbios metabólicos em geral.
Princípios básicos da regulação de ETAR
A regulação do CBS baseia-se em 3 princípios fundamentais:
1. constância do pH . Os mecanismos reguladores do CBS mantêm um pH constante.
2. isosmolaridade . Ao regular o CBS, a concentração de partículas no fluido intercelular e extracelular não muda.
3. neutralidade elétrica . Ao regular o CBS, o número de partículas positivas e negativas no fluido intercelular e extracelular não muda.
MECANISMOS DE REGULAÇÃO DE SPAT
- Mecanismo físico-químico , estes são sistemas tampão de sangue e tecidos;
- Mecanismo fisiológico , são órgãos: pulmões, rins, tecido ósseo, fígado, pele, trato gastrointestinal.
- Metabólico (no nível celular).
Violações da ETAR – classificação por mecanismos? Vias bioquímicas de compensação.
VIOLAÇÕES RESPIRATÓRIAS
Compensação para CBS- uma reação adaptativa por parte do corpo que não é culpada de violar o CBS.
Correção de CBS– uma reação adaptativa por parte do órgão que causou a violação do CBS.
Existem dois tipos principais de distúrbios da CBS – acidose e alcalose.
Acidose– excesso absoluto ou relativo de ácidos ou deficiência de bases.
Alcalose– excesso absoluto ou relativo de bases ou deficiência de ácidos.
A acidose ou alcalose nem sempre é acompanhada por uma mudança perceptível na concentração de H +, uma vez que os sistemas tampão mantêm um pH constante. Tais acidoses e alcaloses são chamadas compensado (seu pH é normal). AN ↔ A - + N + , N + + B - ↔ BH
Se durante a acidose ou alcalose a capacidade tampão for esgotada, o valor do pH muda e é observado o seguinte: acidemia – diminuição do valor do pH abaixo do normal, ou alcalemia - aumento do valor do pH acima do normal. Tais acidoses e alcaloses são chamadas descompensado .
A homeostase é uma das principais propriedades dos seres vivos para manter a dinâmica relativa
constância do ambiente interno, ou seja, composição química, osmótica
pressão, estabilidade das funções fisiológicas básicas.
Esta é a capacidade do corpo de manter uma relativa constância do ambiente interno (sangue, linfa, fluido intercelular).
O corpo humano adapta-se às condições ambientais em constante mudança, mas o ambiente interno permanece constante e os seus indicadores flutuam dentro de limites muito estreitos. Portanto, uma pessoa pode viver em diferentes condições ambientais. Alguns parâmetros fisiológicos são regulados de maneira especialmente cuidadosa e sutil, por exemplo, temperatura corporal, pressão arterial, glicose, gases, sais, íons de cálcio no sangue, equilíbrio ácido-base, volume sanguíneo, pressão osmótica, apetite e muitos outros. A regulação é realizada com base no princípio do feedback negativo entre receptores que detectam alterações nestes indicadores e sistemas de controle. Assim, a diminuição de um dos parâmetros é captada pelo receptor correspondente, de onde são enviados impulsos para uma ou outra estrutura do cérebro, ao comando do qual o sistema nervoso autônomo aciona mecanismos complexos para equalizar as mudanças ocorridas. . O cérebro usa dois sistemas principais para manter a homeostase: autônomo e endócrino.
Um dos parâmetros físico-químicos mais importantes do ambiente interno é equilíbrio ácido-base .
A reação quantitativa do sangue caracteriza o índice de hidrogênio (pH) - o logaritmo decimal negativo da concentração de hidrogênio e íons.
A maioria das soluções no corpo são soluções tampão, em que o pH não muda quando pequenas quantidades de um ácido forte ou alcalino são adicionadas a eles.
Fluido tecidual, sangue, urina e outros fluidos são soluções tampão.
O indicador de pH dos fluidos corporais demonstra claramente quanto Na, Mg, Ca, K é absorvido. Esses 4 componentes regulam a acidez do corpo. Se a acidez for alta, as substâncias começam a ser emprestadas de outros órgãos e cavidades. Para realizar todas as funções das estruturas vivas em todos os níveis, desde sistemas moleculares até órgãos, é necessário um ambiente ligeiramente alcalino (pH 7,4).
Mesmo o menor desvio do valor normal pode causar patologia.
Mudanças de pH: para ácido – acidose
para alcalino – alcalose
Uma mudança de 0,1 pode levar à perturbação do ambiente e uma mudança de 0,3 pode ser fatal.
Padrões de pH para sangue e outros fluidos internos. Metabolismo e metabólitos.
Padrões para fluidos internos:
Sangue arterial 7,35 – 7,45
Sangue venoso 7,26 – 7,36
Linfa 7,35 – 7,40
Fluido intercelular 7,26 – 7,38
pH da urina 5-7 (a acidez muda dependendo da ingestão de alimentos e atividade física. Alcalinidade da urina – alimentos vegetais; acidez da urina – carne, atividade física).
Desvios e normas:
- Reação líquida ácida
Jejum, aumento da temperatura corporal, diabetes, insuficiência renal, trabalho físico pesado.
- Reação alcalina
Inflamação da bexiga, dieta pobre em produtos cárneos, excesso de água mineral, sangue na urina.
Qualquer organismo é caracterizado por um conjunto de indicadores pelos quais são avaliadas as propriedades físico-químicas do meio interno, exceto o pH, que é estimado pelo logaritmo decimal inverso p e p, bem como volume sistólico do coração, frequência cardíaca, sangue pressão, velocidade do fluxo sanguíneo, resistência vascular periférica, volume minuto de respiração etc. A totalidade desses indicadores caracteriza o nível funcional do corpo.
O metabolismo é um conjunto de reações químicas que ocorrem nas células vivas e
fornecendo ao corpo substâncias e energia para o metabolismo básico.
Os metabólitos são produtos do metabolismo intracelular que estão sujeitos à eliminação final do corpo.