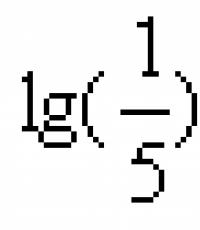Leveren utfører også en utskillelsesfunksjon, og frigjør gallesalter, bilirubin, kolesterol, fettsyrer, lecitin, kalsium, klor, natrium og bikarbonater fra kroppen. Blodreaksjon. Buffersystemer. Syre-base-balanse (ABC) Syre-base-forstyrrelser
1. Agapov Yu.Ya. Syre-base balanse. – M., 1968. – 184 s.
2. Voinov V.A. Atlas for patofysiologi. – M., 2004. – 218 s.
3. Gusev G.P. Nyrens rolle i reguleringen av syre-basebalansen // Fysiologi av nyrene: En guide til fysiologi. – L., 1972. – S. 142–168.
4. Zhalko-Titarenko V.F. Vann-elektrolyttmetabolisme og syre-basestatus under normale og patologiske forhold. – Kiev, 1989.
5. Kostyuchenko S.S. Syre-base balanse i intensivbehandling. – Minsk, 2009. – 268 s.
6. Losev N.I., Voinov V.A. Fysisk-kjemiske homeostase av kroppen // Homeostase / Red. P.D. Horizontova. – M., 1981. – S. 186–240.
7. Malyshev V.D. Syre-basetilstand og vann-elektrolyttbalanse i intensivbehandling: Lærebok. – M.: OJSC “Publishing House “Medicine”, 2005. – 228 s.
8. Ruth G. Syre-base status og elektrolyttbalanse. – M., 1978. 118 s.
9. Tavs G. Blodgasser og syre-basebalanse // Human Physiology. T.3 / Utg. R. Schmidt og G. Tavs. – M., 1986. – S. 241–268.
10. Heitz U., Horn M. Vann-elektrolytt- og syre-basebalanse: en kort veiledning. – M.: BINOM. Kunnskapslaboratoriet, 2009. – 359 s.
11. Hruska K. Patofysiologi av syre-base metabolisme // Nyrer og homeostase i helse og patologi. – M., 1987. – S. 170–216.
Syre-base-tilstanden (ABS) i kroppen er en av de viktigste og mest strengt stabiliserte parametrene for homeostase. Forholdet mellom hydrogen og hydroksylioner i det indre miljøet i kroppen bestemmer aktiviteten til enzymer, hormoner, intensiteten og retningen av redoksreaksjoner, metabolske prosesser av proteiner, karbohydrater og fett, funksjonene til forskjellige organer og systemer, konstansen til vann- og elektrolyttmetabolisme, permeabiliteten og eksitabiliteten til biologiske membraner og etc. Aktiviteten til reaksjonen til miljøet påvirker hemoglobinets evne til å binde oksygen og frigjøre det til vev.
Den aktive reaksjonen i miljøet vurderes vanligvis ut fra innholdet av hydrogenioner i væsker.
pH-verdien er en av de mest "strenge" blodparametrene og svinger normalt innenfor et veldig smalt område hos mennesker - pH i arterielt blod er 7,35-7,45; venøs - 7,32-7,42. Mer signifikante endringer i blodets pH er assosiert med patologiske metabolske forstyrrelser. I andre kroppsvæsker og celler kan pH avvike fra pH i blod.
Forandringer i blodets pH utover de spesifiserte grensene fører til betydelige endringer i redoksprosesser, endringer i enzymaktivitet, permeabilitet av biologiske membraner og forårsaker forstyrrelser i funksjonen til kardiovaskulære, respiratoriske og andre systemer; et skifte på 0,3 kan forårsake komatøse tilstander, og et skifte på 0,4 er ofte uforenlig med livet.
Syre-base-tilstanden opprettholdes av kraftige homeostatiske mekanismer. De er basert på særegenhetene til de fysisk-kjemiske egenskapene til blodbuffersystemer og fysiologiske prosesser der de ytre respirasjonssystemene, nyrene, leveren, mage-tarmkanalen, etc. deltar.
Kjemiske buffersystemer danner den første forsvarslinjen mot endringer i pH i kroppsvæsker og virker raskt for å forhindre dem.
Et buffersystem er en blanding som har evnen til å forhindre endringer i pH i mediet når syrer eller baser tilsettes det. Buffersystemer fjerner ikke H+ fra kroppen, men "binder" den med sin alkaliske komponent frem til den endelige restaureringen av CBS. Blandinger som består av en svak syre og dens salt som inneholder en sterk base, eller en svak base og et salt av en sterk syre, har bufferegenskaper.
De mest romslige blodbuffersystemene er bikarbonat, fosfat, protein og hemoglobin. De tre første systemene spiller en spesielt viktig rolle i blodplasma, og hemoglobinbufferen, den kraftigste, virker i erytrocytter.
Bikarbonatbufferen er det viktigste ekstracellulære buffersystemet og består av svak karbonsyre H2CO3 og dets anionsalt, en sterk base. Karbonsyre dannes som et resultat av samspillet mellom karbondioksid og vann: CO2 + H2O ↔ H2CO3. Karbonsyre på sin side dissosieres til hydrogen og bikarbonat: H2CO3 ↔ H+ + HCO3-.
Under normale forhold (ved en blod-pH på ca. 7,4) er det 20 ganger mer bikarbonat i plasma enn karbondioksid.
Kapasiteten til bikarbonatsystemet utgjør 53 % av den totale bufferkapasiteten til blodet. Samtidig utgjør plasmabikarbonat 35 % og erytrocyttbikarbonat 18 % av bufferkapasiteten.
Når et overskudd av syrereagerende produkter dannes i plasmaet, kombineres hydrogenioner med bikarbonatanioner (). Overskuddet av karbondioksid som dannes i plasmaet går inn i de røde blodcellene og der, ved hjelp av karbonsyreanhydrase, spaltes det til karbondioksid og vann. Karbondioksid frigjøres i plasma, stimulerer respirasjonssenteret og overflødig CO2 fjernes fra kroppen gjennom lungene. Denne raske omdannelsen av enhver syre med bikarbonat til karbonsyre, som lett fjernes av lungene, gjør bikarbonatbuffer til det mest labile buffersystemet.
En bikarbonatbuffer kan også nøytralisere overskudd av baser. I dette tilfellet vil OHˉ-ionene være bundet av karbondioksid og i stedet for den sterkeste basen OHˉ dannes det en svakere base, hvis overskudd skilles ut av nyrene i form av bikarbonatsalter.
Så lenge mengden karbonsyre og natriumbikarbonat endres proporsjonalt og forholdet mellom dem forblir 1:20, holder blodets pH seg innenfor normale grenser.
Fosfatbuffer er representert av salter av mono- og disubstituerte fosfater. Fosfatbuffersystemet gir 5 % av bufferkapasiteten til blodet og er cellenes hovedbuffersystem.
Et monosubstituert salt har sure egenskaper, siden det ved dissosiasjon produserer et ion, som deretter er i stand til å frigjøre et hydrogenion: NaH2PO4 ⇒ Na+ + ; ⇒Н+ + . Disubstituert fosfat har egenskapene til en base, siden det dissosieres for å danne et ion som kan binde et hydrogenion: + H+ ⇒.
Ved normal pH i plasma er forholdet mellom fosfatsalter NaH2PO4: Na2HPO4 = 1:4. Denne bufferen er viktig i nyrereguleringen av CBS, så vel som i reguleringen av responsen til visse vev. I blodet reduseres effekten hovedsakelig til å opprettholde konstansen og reproduksjonen av bikarbonatbufferen.
Proteinbuffersystemet er en ganske kraftig buffer som er i stand til å vise sine egenskaper på grunn av proteiners amfotere natur. Proteinbuffersystemet gir 7 % av bufferkapasiteten til blodet. Blodplasmaproteiner inneholder en tilstrekkelig mengde sure og basiske radikaler, så dette buffersystemet virker avhengig av miljøet der proteinene dissosieres.
Hemoglobinbuffer er det mest romslige buffersystemet. Den står for opptil 75 % av den totale bufferkapasiteten til blodet. Egenskapene til et buffersystem er gitt til hemoglobin hovedsakelig ved dets evne til konstant å eksistere i form av to former - redusert (redusert) hemoglobin HHb og oksidert (oksyhemoglobin) HbO2.
Hemoglobinbuffer, i motsetning til bikarbonatbuffer, er i stand til å nøytralisere både ikke-flyktige og flyktige syrer. Oksidert hemoglobin oppfører seg som en syre, øker konsentrasjonen av hydrogenioner, og redusert (deoksygenert) oppfører seg som en base, og nøytraliserer H+.
Hemoglobin er et klassisk eksempel på en proteinbuffer, og dens effektivitet er ganske høy. Hemoglobin er seks ganger mer effektivt som buffer enn plasmaproteiner.
Overgangen av den oksiderte formen av hemoglobin til den reduserte formen forhindrer et skifte i pH til den sure siden under kontakt av blod med vev, og dannelsen av oksyhemoglobin i lungekapillærene forhindrer et skifte i pH til den alkaliske siden på grunn av frigjøringen av CO2 og klorioner fra erytrocytter og dannelsen av bikarbonat i dem.
Ammoniakk/ammoniumionesystemet (NH3/NH4+) - virker primært i urin.
I tillegg til buffersystemer, tar fysiologiske systemer en aktiv del i å opprettholde en konstant pH, hvorav de viktigste er lungene, nyrene, leveren og mage-tarmkanalen.
Luftveiene spiller en betydelig rolle for å opprettholde syre-basebalansen i kroppen, men det tar 1-3 minutter å jevne ut skiftet i blodets pH. Lungenes rolle reduseres til å opprettholde normale karbondioksidkonsentrasjoner, og hovedindikatoren på lungenes funksjonelle tilstand er den delvise spenningen av karbondioksid i blodet. Lungemekanismer gir midlertidig kompensasjon, siden dette forskyver oksyhemoglobin-dissosiasjonskurven til venstre og reduserer oksygenkapasiteten til arterielt blod.
Ved jevn gassutveksling fjerner lungene omtrent 850 g karbondioksid per dag. Hvis karbondioksidspenningen i blodet øker over det normale med 10 mmHg. Art., ventilasjon øker 4 ganger.
Nyrenes rolle i å regulere den aktive reaksjonen til blodet er ikke mindre viktig enn aktiviteten til luftveiene. Nyrekompensasjonsmekanismen er tregere enn den respiratoriske. Full nyrekompensasjon utvikles bare noen få dager etter pH-endringen.
Utskillelsen av syrer under normal blandet mat hos en frisk person overstiger utskillelsen av baser, så urinen har en sur reaksjon (pH 5,3-6,5) og konsentrasjonen av hydrogenioner i den er omtrent 800 ganger høyere enn i blodet. Nyrene produserer og skiller ut i urinen en mengde hydrogenioner som tilsvarer mengden som kontinuerlig kommer inn i plasma fra kroppens celler, mens de erstatter hydrogenionene som skilles ut av det tubulære epitelet med natriumioner i primærurinen. Denne mekanismen oppnås gjennom flere kjemiske prosesser.
Den første av disse er prosessen med natriumreabsorpsjon under omdannelsen av dibasiske fosfater til monosubstituerte. Når fosfatbufferen er oppbrukt (urin pH under 4,5), reabsorberes natrium og bikarbonat gjennom ammoniagenese.
Den andre prosessen, som sikrer oppbevaring av natrium i kroppen og fjerning av overflødige hydrogenioner, er omdannelsen av bikarbonater til karbonsyre i lumen av tubuli.
Den tredje prosessen som bidrar til oppbevaring av natrium i kroppen er syntesen av ammoniakk i de distale nyretubuli (ammoniogenese) og dens bruk for å nøytralisere og skille ut sure ekvivalenter i urinen.
Den resulterende frie ammoniakken trenger lett inn i lumen av tubuli, hvor den, kombinert med et hydrogenion, blir til et dårlig diffunderbart ammoniumkation, som ikke er i stand til å returnere til cellen i tubuliveggen.
Generelt kan konsentrasjonen av hydrogenioner i urinen overstige konsentrasjonen av hydrogenioner i blodet med flere hundre ganger.
Dette indikerer nyrenes enorme evne til å fjerne hydrogenioner fra kroppen.
Nyremekanismene for regulering av luftveiene kan ikke justere pH i løpet av noen få minutter, slik som respirasjonsmekanismen, men de fungerer i flere dager til pH er tilbake til normale nivåer.
Regulering av CBS med deltakelse av leveren. Leveren oksiderer underoksiderte stoffer i blodet som strømmer fra tarmene til sluttprodukter; syntetiserer urea fra nitrogenholdig avfall, spesielt fra ammoniakk og ammoniumklorid, som kommer fra mage-tarmkanalen inn i blodet i portvenen; Leveren har en utskillelsesfunksjon og derfor, når overskytende mengder sure eller alkaliske stoffskifteprodukter samler seg i kroppen, kan de skilles ut med galle til mage-tarmkanalen. Med et overskudd av syrer i leveren øker deres nøytralisering og samtidig hemmes dannelsen av urea. Ubrukt ammoniakk nøytraliserer syrer og øker utskillelsen av ammoniumsalter i urinen. Med en økning i mengden av alkaliske valenser øker urindannelsen, og ammoniaogenesen avtar, som er ledsaget av en reduksjon i utskillelsen av ammoniumsalter i urinen.
Konsentrasjonen av hydrogenioner i blodet avhenger også av aktiviteten til mage og tarm. Celler i mageslimhinnen skiller ut saltsyre i svært høye konsentrasjoner. I dette tilfellet frigjøres klorioner fra blodet inn i magehulen i kombinasjon med hydrogenioner dannet i mageepitelet med deltakelse av karbonsyreanhydrase. I stedet for klorider kommer bikarbonat inn i plasmaet under gastrisk sekresjon.
Bukspyttkjertelen er aktivt involvert i å regulere blodets pH, da den genererer store mengder bikarbonat. Dannelsen av bikarbonat hemmes av et overskudd av syrer og forsterkes av deres mangel.
Huden kan, under forhold med overflødig ikke-flyktige syrer og baser, frigjøre sistnevnte gjennom svette. Dette er spesielt viktig i tilfeller med nedsatt nyrefunksjon.
Bein. Dette er det tregeste systemet. Mekanismen for dets deltakelse i reguleringen av blodets pH er evnen til å bytte Ca2+ og Na+ ioner med blodplasma i bytte mot H+ protoner. Oppløsningen av hydroksyapatittkalsiumsalter av benmatrisen skjer, frigjøring av Ca2+-ioner og binding av HPO42-ioner med H+ for å danne dihydrogenfosfat, som skilles ut i urinen. Parallelt, med en nedgang i pH (forsuring), kommer H+ ioner inn i osteocyttene, og kaliumioner strømmer ut.
Vurdering av syre-base tilstanden i kroppen
Når man studerer syre-base-balansen, er blodprøver av størst betydning. Indikatorer i kapillærblod er nær de i arterielt blod. For tiden bestemmes CBS-indikatorer ved å bruke Astrup-ekvilibreringsmikrometoden. Denne teknikken lar deg, i tillegg til den sanne blod-pH, få en indikator på CO2-spenning i plasma (pCO2), ekte blodbikarbonat (AB), standard bikarbonat (SB), summen av alle blodbaser (BB) og en indikator av basemangel eller overskudd (BE).
Bibliografisk lenke
Morrison V.V., Chesnokova N.P., Bizenkova M.N. SYRE-BASE TILSTAND. REGULERING AV SYREBASE HOMEOSTASIS (FOREDELSE 1) // International Journal of Applied and Fundamental Research. – 2015. – nr. 3-2. – S. 270-273;URL: https://applied-research.ru/ru/article/view?id=6529 (tilgangsdato: 15.06.2019). Vi gjør deg oppmerksom på magasiner utgitt av forlaget "Academy of Natural Sciences"
2.Blodbuffersystemer. Rollen til buffersystemer for å opprettholde pH-homeostase. Syre-base tilstand. Konseptet med acidose og alkalose.
I kroppen dominerer syredannelsen over dannelsen av basiske forbindelser.
Kilder til H+ i kroppen:
1. flyktig syre H2CO3, 10-20 tusen mmol CO2 per dag under oksidasjon av proteiner, F, U.
2.ikke-flyktige syrer per dag. 70 mmol:
Fosforholdig ved nedbrytning av organiske fosfater (nukleotider, PL, fosfoproteiner)
Svovelsyre, saltsyre under oksidasjon B
3.org.k-you: melk, ketonlegemer, PVC, etc.
pH holdes på et lett alkalisk nivå på grunn av deltakelse av bufferceller og fysiologisk kontroll (utskillelsesfunksjon av nyrene og respirasjonsfunksjon av lungene)
Henderson-Hesselbach-ligning: pH = pKa + log [protonakkumulator]/[protondonor].
(Salt) (syre)
Enhver buffer består av et konjugert syre-basepar: protondonor + akseptor.
Bufferkapasitet: avhenger av de absolutte konsentrasjonene av bufferkomponentene.
Bikarbonat.
10 % bufferblodkapasitet.
Ved normal blod-pH (7,4) overstiger konsentrasjonen av bikarbonationer HCO 3 i blodplasma konsentrasjonen av CO 2 med omtrent 20 ganger. Bikarbonatbuffersystemet fungerer som en effektiv regulator i pH-området 7,4.
Virkningsmekanismen til dette systemet er at når relativt store mengder sure produkter frigjøres i blodet, samhandler hydrogenioner H+ med bikarbonationer HCO 3 –, noe som fører til dannelse av svakt dissosierende karbonsyre H 2 CO 3. En påfølgende reduksjon i konsentrasjonen av H 2 CO 3 oppnås som et resultat av den akselererte frigjøringen av CO 2 gjennom lungene som et resultat av deres hyperventilering (husk at konsentrasjonen av H 2 CO 3 i blodplasmaet bestemmes av trykk av CO 2 i den alveolære gassblandingen).
Hvis mengden av baser i blodet øker, samhandler de med svak karbonsyre for å danne bikarbonationer og vann. I dette tilfellet forekommer ingen merkbare endringer i pH-verdien. I tillegg, for å opprettholde et normalt forhold mellom komponentene i buffersystemet, aktiveres i dette tilfellet fysiologiske mekanismer for å regulere syre-basebalansen: en viss mengde CO 2 beholdes i blodplasmaet som et resultat av hypoventilering av lungene.
NaHC03 + H+ → Na+ + H2CO3
Reabs i nyrene ↓karbonsyreanhydrase
↓økt ventilasjon av lungene
Fosfat er et konjugert syre-basepar som består av et H 2 PO 4 - ion (protondonor) og et HPO 4 2 - ion (protonakseptor):
 Fosfatbuffersystemet utgjør bare 1 % av bufferkapasiteten til blodet. I ekstracellulær væske, inkludert blod, er forholdet [HPO 4 2– ]: [H 2 PO 4 – ] 4:1. Buffereffekten til fosfatsystemet er basert på muligheten for å binde hydrogenioner med HPO 4 2– ioner for å danne H 2 PO 4 – (H + + + HPO 4 2– -> H 2 PO 4 –), samt OH – ioner med H 2 PO ioner 4 – (OH – + + H 2 R O 4 – -> HPO 4 2– + H 2 O). Bufferparet (H 2 PO 4 – –HPO 4 2–) er i stand til å påvirke endringer i pH i området fra 6,1 til 7,7 og kan gi en viss bufferkapasitet til den intracellulære væsken, hvis pH-verdi er i området. av 6,9–7, 4. I blodet vises den maksimale kapasiteten til fosfatbufferen rundt pH-verdien på 7,2.
Fosfatbuffersystemet utgjør bare 1 % av bufferkapasiteten til blodet. I ekstracellulær væske, inkludert blod, er forholdet [HPO 4 2– ]: [H 2 PO 4 – ] 4:1. Buffereffekten til fosfatsystemet er basert på muligheten for å binde hydrogenioner med HPO 4 2– ioner for å danne H 2 PO 4 – (H + + + HPO 4 2– -> H 2 PO 4 –), samt OH – ioner med H 2 PO ioner 4 – (OH – + + H 2 R O 4 – -> HPO 4 2– + H 2 O). Bufferparet (H 2 PO 4 – –HPO 4 2–) er i stand til å påvirke endringer i pH i området fra 6,1 til 7,7 og kan gi en viss bufferkapasitet til den intracellulære væsken, hvis pH-verdi er i området. av 6,9–7, 4. I blodet vises den maksimale kapasiteten til fosfatbufferen rundt pH-verdien på 7,2.
1 og 2 – utgang.
Protein er mindre viktig for å opprettholde COR i blodplasmaet enn andre buffersystemer. Proteiner danner et buffersystem på grunn av tilstedeværelsen av syre-basegrupper i proteinmolekylet: protein–H + (syre, protondonor) og protein (konjugatbase, protonakseptor). Proteinbuffersystemet i blodplasma er effektivt i pH-området 7,2–7,4.
Hemoglobinbuffersystemet er det kraftigste buffersystemet i blodet. Den er 9 ganger kraftigere enn en bikarbonatbuffer; den står for 75 % av den totale bufferkapasiteten til blodet. består av ikke-ionisert hemoglobin HHb (svak organisk syre, protondonor) og kaliumsalt av hemoglobin KHb (konjugatbase, protonakseptor). Oksyhemoglobinbuffersystemet kan vurderes på samme måte. Hemoglobinsystemet og oksyhemoglobinsystemet er interkonvertible systemer og eksisterer som en helhet.
Virkningsmekanismen:
I vev: H2O + CO2 (karbonsyreanhydrase) -> H2CO3 -> H + + HCO3 - (diffunderer til blodplasma)
KNvO2 ->KNv + 4O2
KHb + 2H+ -> HHb + 2K+ (K-hemoglobin nøytraliserer H+ ioner)
I lungene: HHb + 4O2 -> 2H+ + HbO2
2H+ + HBO2 + 2K+ + 2HCO3- ->KHBO2 + 2H2CO3 (karbonsyreanhydrase) ->H2O + 2CO2
pH og CO2-konsentrasjon påvirker frigjøring og binding av O2 ved nemoglobin - Boreffekt.
Å øke konsentrasjonen av protoner, CO2, fremmer frigjøringen av O2, og å øke konsentrasjonen av O2 stimulerer frigjøringen av CO2 og protoner.
Syre-base tilstand (ABS)- den relative konstanten av reaksjonen til det indre miljøet i kroppen, kvantitativt preget av konsentrasjonen av H +.
H+-konsentrasjonen uttrykkes ved hjelp av pH-verdien. Konsentrasjonen av H +, og følgelig pH-verdien, avhenger av forholdet mellom syrer og baser i kroppen.
Bronsted syrer - molekyler eller ioner som er i stand til å donere H+.
Brønsted Stiftelser - forbindelser som er i stand til å akseptere H+.
Den vanligste syren i kroppen er karbonsyre, det dannes ca. 20 mol per dag. Kroppen produserer også andre uorganiske (saltsyre, svovelsyre, fosforsyre) og organiske (amino-, keto-, hydroksy-, nuklein-, fettsyrer) i en mengde på 80 mmol/dag.
den sterkeste av dem er ammoniakk. Aminosyrene arginin og lysin, biogene aminer, for eksempel katekolaminer, histamin, serotonin osv. har også grunnleggende egenskaper.
Biologisk betydning av pH-regulering, konsekvenser av brudd
H + er positivt ladede partikler de slutter seg til negativt ladede grupper av molekyler og anioner, som et resultat av at de endrer deres sammensetning og egenskaper. Dermed bestemmer mengden H + i en væske strukturen og egenskapene til alle hovedgrupper av organiske forbindelser - proteiner, nukleinsyrer, karbohydrater og lipider (amfifile). Den viktigste effekten av H+-konsentrasjon er på enzymaktivitet. Hvert enzym har sin egen optimale pH, hvor enzymet har maksimal aktivitet. For eksempel er enzymene til glykolyse, TCA-syklus, PFS aktive i et nøytralt miljø, og lysosomale enzymer og mageenzymer er aktive i et surt miljø (pH = 2). Som et resultat forårsaker endringer i pH endringer i aktiviteten til individuelle enzymer og fører til metabolske forstyrrelser generelt.
Grunnleggende prinsipper for regulering av renseanlegg
Reguleringen av CBS er basert på 3 hovedprinsipper:
1. pH-konstans . Reguleringsmekanismene til CBS opprettholder en konstant pH.
2. isosmolaritet . Ved regulering av CBS endres ikke konsentrasjonen av partikler i den intercellulære og ekstracellulære væsken.
3. elektrisk nøytralitet . Ved regulering av CBS endres ikke antall positive og negative partikler i den intercellulære og ekstracellulære væsken.
MEKANISMER FOR SPAT REGULERING
- Fysisk-kjemisk mekanisme , disse er buffersystemer av blod og vev;
- Fysiologisk mekanisme , disse er organer: lunger, nyrer, beinvev, lever, hud, mage-tarmkanalen.
- Metabolsk (på mobilnivå).
Brudd på renseanlegg - klassifisering etter mekanismer? Biokjemiske veier for kompensasjon.
PUSTEBRUK
Kompensasjon til CBS- en adaptiv reaksjon fra den delen av kroppen som ikke er skyldig i brudd på CBS.
Korrigering av CBS– en adaptiv reaksjon fra den delen av organet som forårsaket brudd på CBS.
Det er to hovedtyper av CBS-lidelser - acidose og alkalose.
Acidose– absolutt eller relativt overskudd av syrer eller mangel på baser.
Alkalose– absolutt eller relativt overskudd av baser eller mangel på syrer.
Acidose eller alkalose er ikke alltid ledsaget av en merkbar endring i H + konsentrasjon, siden buffersystemer opprettholder en konstant pH. Slike acidoser og alkaloser kalles kompensert (deres pH er normal). AN ↔ A - + N + , N + + B - ↔ BH
Hvis bufferkapasiteten er brukt opp under acidose eller alkalose, endres pH-verdien og følgende observeres: acidemi – reduksjon i pH-verdi under normalen, eller alkalemi - økning i pH-verdi over normalen. Slike acidoser og alkaloser kalles dekompensert .
Homeostase er en av hovedegenskapene til levende ting for å opprettholde relativ dynamikk
det indre miljøets konstanthet, dvs. kjemisk sammensetning, osmotisk
trykk, stabilitet av grunnleggende fysiologiske funksjoner.
Dette er kroppens evne til å opprettholde en relativ konstanthet i det indre miljøet (blod, lymfe, intercellulær væske).
Menneskekroppen tilpasser seg stadig skiftende miljøforhold, men det indre miljøet forblir konstant og indikatorene svinger innenfor svært trange grenser. Derfor kan en person leve under forskjellige miljøforhold. Noen fysiologiske parametere reguleres spesielt nøye og subtilt, for eksempel kroppstemperatur, blodtrykk, glukose, gasser, salter, kalsiumioner i blodet, syre-basebalanse, blodvolum, dets osmotiske trykk, appetitt og mange andre. Regulering utføres etter prinsippet om negativ tilbakemelding mellom reseptorer som oppdager endringer i disse indikatorene og kontrollsystemene. Dermed fanges en reduksjon i en av parametrene opp av den tilsvarende reseptoren, hvorfra impulser sendes til en eller annen struktur i hjernen, på kommando av hvilken det autonome nervesystemet slår på komplekse mekanismer for å utjevne endringene som har skjedd . Hjernen bruker to hovedsystemer for å opprettholde homeostase: autonom og endokrin.
En av de viktigste fysisk-kjemiske parametrene til det indre miljøet er syre-base balanse .
Den kvantitative reaksjonen til blodet karakteriserer hydrogenindeksen (pH) - den negative desimallogaritmen for konsentrasjonen av hydrogen og ioner.
De fleste løsninger i kroppen er bufferløsninger, der pH ikke endres når små mengder av en sterk syre eller alkali tilsettes dem.
Vevsvæske, blod, urin og andre væsker er bufferløsninger.
pH-indikatoren for kroppsvæsker viser tydelig hvor mye Na, Mg, Ca, K som absorberes. Disse 4 komponentene regulerer surheten i kroppen. Hvis surheten er høy, begynner stoffer å bli lånt fra andre organer og hulrom. For å utføre alle funksjonene til levende strukturer på alle nivåer fra molekylære systemer til organer, kreves et lett alkalisk miljø (pH 7,4).
Selv det minste avvik fra normalverdien kan forårsake patologi.
pH-endringer: til sur – acidose
til alkalisk – alkalose
Et skifte på 0,1 kan føre til forstyrrelse av miljøet, og et skifte på 0,3 kan være livstruende.
pH-standarder for blod og andre indre væsker. Metabolisme og metabolitter.
Standarder for interne væsker:
Arterielt blod 7,35 – 7,45
Venøst blod 7,26 – 7,36
Lymfe 7.35 – 7.40
Intercellulær væske 7,26 – 7,38
Urin pH 5-7 (surhet endres avhengig av matinntak og fysisk aktivitet. Urin alkalitet – plantemat; urin surhet – kjøtt, fysisk aktivitet).
Avvik og normer:
- Sur væskereaksjon
Faste, økt kroppstemperatur, diabetes, nedsatt nyrefunksjon, tungt fysisk arbeid.
- Alkalisk reaksjon
Betennelse i blæren, kosthold fattig på kjøttprodukter, overflødig mineralvann, blod i urinen.
Enhver organisme er preget av et sett med indikatorer som de fysisk-kjemiske egenskapene til det indre miljøet vurderes, bortsett fra pH, som er estimert av den inverse desimallogaritmen p og p, samt slagvolum i hjertet, hjertefrekvens, blod trykk, blodstrømningshastighet, perifer vaskulær motstand, minuttvolum av respirasjon osv. Helheten av disse indikatorene karakteriserer kroppens funksjonsnivå.
Metabolisme er et sett med kjemiske reaksjoner som forekommer i levende celler og
gi kroppen stoffer og energi for grunnleggende metabolisme.
Metabolitter er produkter av intracellulær metabolisme som er gjenstand for endelig eliminering fra kroppen.